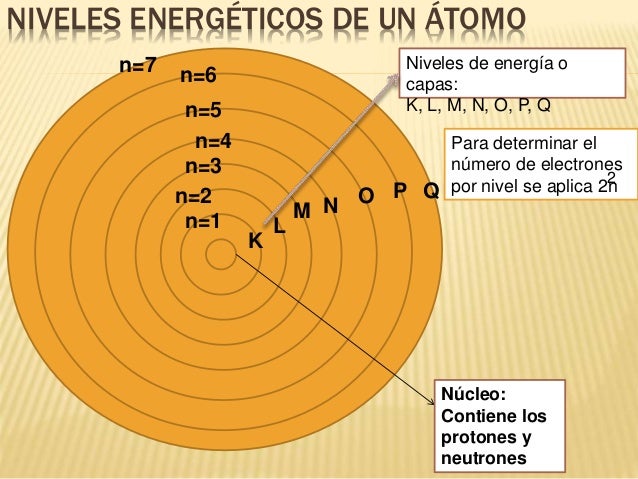
La configuración electrónica Indica la
distribución de los electrones de un átomo. Para ello se debe tener en cuenta la distribución electrónica que consiste en cada órbita posee un determinado nivel de energía (n), cada nivel de energía está
representado por una letra entre " K, L, M, N O , P, Q"
Cada nivel de energía indican la distancia existente entre el electrón y el núcleo.
A medida que se encuentran más alejados del núcleo los electrones tienen más
energía.Para determinar el
número de electrones que pueden entrar en un nivel se calcula mediante la
fórmula 2n2,
en donde “n” es el nivel de energía.
Entonce remplazamos "n" por el número del nivel y hacemos la operación, primer se despeja la potencia y luego se multiplica
Nivel 1 = 2(1)2
Nivel 1= 2 (1) = 2
Nivel 2 = 2(2)2
Nivel 2 = 2 (4) = 8
Entonce remplazamos "n" por el número del nivel y hacemos la operación, primer se despeja la potencia y luego se multiplica
Nivel 1 = 2(1)2
Nivel 1= 2 (1) = 2
Nivel 2 = 2(2)2
Nivel 2 = 2 (4) = 8
De esta forma tenemos que según el nivel es el número de electrones:
Del nivel 5 al 7 mantenemos los mismos 32 electrones finales. Ahora dentro
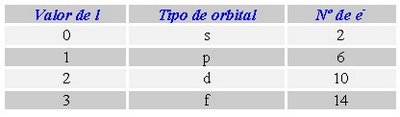
de un nivel de energía hay subdivisiones llamados subniveles, los cuales se
simbolizan con las letras minúsculas s,p,d,f. Los cuales a su vez también tienen un límite máximo de electrones:
Ahora para realizar la configuración electrónica debo tener en cuenta el diagrama de MOELLER, que explica
el orden en los que se van llenando los subniveles para realizar la
configuración electrónica.
Se debe entender el significado del diagrama de Moeller de la siguiente manera:
Así siguiendo el orden del diagrama de Moeller, tenemos en cuenta el número atómico (Z) que me indica la cantidad de electrones presentes en el átomo, y siguiendo el orden del diagrama voy contando los subíndices hasta alcanzar el número de electrones deseado. Ejemplo el calcio tiene como número atómico el 20, por consiguiente su configuración será:
ACTIVIDAD
1. Realizar la configuración electrónica de los siguientes elementos químicos:
Azufre(número atómico 16)
Francio (número atómico 87)
Estroncio (número atómico 38)
Selenio (número atómico 34)
Yodo (número atómico 53)
2. Escribe en una tabla la cantidad de electrones que posee cada elemento por niveles
3. Responde las siguientes preguntas, de las configuraciones electrónicas del primer punto:
- ¿Cuál elemento no completa el nivel "M"?
- ¿Cuál elemento posee electrones en el nivel "Q"?
- ¿Cuales elementos tienen lleno el nivel "N"?
Ahora los números cuántico describen
las características de un electrón situado en un determinado orbital, son varios y los sacamos de la siguiente manera:
NÚMERO
CUÁNTICO PRINCIPAL
Se
representa por la letra “n” y define la capa o nivel de energía en la periferia
del núcleo del átomo. Así para el ejemplo anterior del CALCIO el nivel más alta es 4 y ese es el valor del número cuántico principal.
NÚMERO
CUÁNTICO SECUNDARIO O AZIMUTAL
Determina
la forma del orbital, es decir la región donde el electrón se mueve. Representa
el subnivel de energía. Se representa
con la letra “l”. Toma los valores comprendidos entre 0 y (n -1). Así que para el mismo ejemplo tendríamos n-1 = 3
NÚMERO
CUÁNTICO MAGNÉTICO
Representado con el símbolo ml . Define la orientación que pueden presentar los orbitales de
un mismo subnivel en relación con el campo magnético externo. Para cada valor de “l” puede tomar valores comprendidos entre – l y + l
Se debe tener en cuenta que cada casilla se representa con 2 flechas o spines que son los electrones que alcanza el nivel, siguiendo con el ejemplo del calcio tenemos que su configuración termina en S2, por consiguiente por terminar en un subnivel S el valor de el número cuántico magnético es 0 "cero".
NÚMERO
CUÁNTICO SPÍN
Se
simboliza “ms”
Representa la dirección de giro del electrón sobre so propio eje. Pueden tomar
solamente 2 valores +1/2 y – ½ y que
también se simboliza con flechas contrarias.
En el mismo ejemplo el último electrón del calcio queda hacia abajo por lo tanto es
- 1/2.
1. Realizar la configuración electrónica de los siguientes elementos químicos:
Azufre(número atómico 16)
Francio (número atómico 87)
Estroncio (número atómico 38)
Selenio (número atómico 34)
Yodo (número atómico 53)
2. Escribe en una tabla la cantidad de electrones que posee cada elemento por niveles
3. Responde las siguientes preguntas, de las configuraciones electrónicas del primer punto:
- ¿Cuál elemento no completa el nivel "M"?
- ¿Cuál elemento posee electrones en el nivel "Q"?
- ¿Cuales elementos tienen lleno el nivel "N"?


Mis apreciados estudiantes con gusto estoy para contestar sus preguntas.
ResponderEliminarComo seria la configuración electrónica del escandio pero con esa tabla de los números cuánticos
EliminarEl escandio posee el número atómico es 21 y sobre ese número se inicia la configuración electrónica siguiendo el diagra de Moller.
Eliminar1S2 - 2S2- 2P6- 3S2- 3P6- 4S2- 3d1.
ok
ResponderEliminar